Radioaktywność
Promieniowanie jonizujące
Skutki promieniowania
Ziemia znajduje się pod ciągłym wpływem przepływu szybkich cząstek i twardych kwantów promieniowanie elektromagnetyczne pochodzi z kosmosu. Strumień ten nazywany jest promieniami kosmicznymi. Promienie kosmiczne pochodzą z głębi wszechświata i ze Słońca. Część strumienia promieniowania kosmicznego dociera do powierzchni Ziemi, a część jest pochłaniana przez atmosferę, wytwarzając promieniowanie wtórne i prowadząc do powstania różnych radionuklidów. Oddziaływanie promieni kosmicznych z materią prowadzi do jej jonizacji.
Nazywa się przepływ cząstek lub kwantów elektromagnetycznych, których oddziaływanie z ośrodkiem prowadzi do jonizacji jego atomów promieniowanie jonizujące.
Promieniowanie jonizujące może być również pochodzenia ziemskiego. Na przykład występują podczas rozpadu radioaktywnego.
Zjawisko promieniotwórczości odkrył w 1896 roku A. Becquerel.
Radioaktywność - zdolność niektórych jąder atomowych do spontanicznego (spontanicznego) przekształcania się w inne jądra wraz z emisją cząstek.
Istnieją dwa rodzaje radioaktywności:
Naturalny, który występuje w naturalnych niestabilnych jądrach;
Sztuczny, który znajduje się w jądrach radioaktywnych powstałych w wyniku różnych reakcje jądrowe.
Oba rodzaje radioaktywności mają ogólne wzorce.
Rozpad promieniotwórczy jest zjawiskiem statystycznym. Można zainstalować prawdopodobieństwo rozpad jednego jądra w określonym czasie. W równych okresach czasu równe udziały dostępnych (tj. jeszcze nierozpadniętych na początku danego okresu) jąder pierwiastka promieniotwórczego rozpadają się.
Niech w krótkim czasie dt rozpada się dN rdzenie. Liczba ta jest proporcjonalna do przedziału czasu dt i całkowitą liczbę jąder radioaktywnych N:
gdzie λ - stała zaniku, proporcjonalna do prawdopodobieństwa rozpadu jądra promieniotwórczego i zależna od charakteru pierwiastka; wskazuje znak „-”. malejące liczba jąder radioaktywnych.
Decyzją równanie różniczkowe(12.23) jest funkcją wykładniczą:
Gdzie N 0- liczba jąder radioaktywnych w danej chwili t = 0, A N- liczba nierozłożonych jąder w danym momencie T.
Wzór (12.24) wyraża prawo rozpad radioaktywny.
Liczba jąder promieniotwórczych maleje w czasie zgodnie z prawem wykładniczym.
W praktyce zamiast stałej zaniku A często stosuje się inną wartość, tzw okres półtrwania.
Okres półtrwania (T)- jest to czas, w którym ulega rozpadowi połowa jądra radioaktywne.
Okres półtrwania może być bardzo długi lub bardzo krótki. Na przykład w przypadku uranu T = 4,5 10 9 lat i dla litu T Li = 0,89 sek.
Charakterystyka rozpadu T i λ są powiązane przez:
Prawo rozpadu promieniotwórczego z wykorzystaniem okresu półtrwania jest zapisane w następujący sposób:
Na ryc. Rysunek 12.7 przedstawia procesy rozpadu radioaktywnego dwóch substancji o różnych okresach półtrwania.

Ryż. 12.7. Zmniejszenie liczby jąder substancji pierwotnej podczas rozpadu radioaktywnego
>> Prawo rozpadu promieniotwórczego. Pół życia
§ 101 PRAWO ROZPADU PROMIENIOTWÓRCZEGO. PÓŁ ŻYCIA
Rozpad promieniotwórczy podlega prawom statystycznym. Rutherford badając przemiany substancji radioaktywnych ustalił eksperymentalnie, że ich aktywność maleje z czasem. Zostało to omówione w poprzednim akapicie. Zatem aktywność radonu zmniejsza się 2 razy po 1 minucie. Aktywność pierwiastków takich jak uran, tor i rad również maleje z czasem, ale znacznie wolniej. Dla każdej substancji promieniotwórczej istnieje pewien przedział czasu, w którym aktywność spada 2-krotnie. Ten przedział nazywa się okresem półtrwania. Okres półtrwania T to czas, w którym rozpada się połowa początkowej liczby atomów radioaktywnych.
Spadek aktywności, czyli liczbę rozpadów na sekundę, w zależności od czasu, dla jednego z radioaktywnych leków pokazano na rysunku 13.8. Okres półtrwania tej substancji wynosi 5 dni.
Wyprowadźmy teraz matematyczną postać prawa rozpadu promieniotwórczego. Niech liczba atomów promieniotwórczych w początkowej chwili (t= 0) będzie równa N 0. Następnie, po okresie półtrwania, liczba ta będzie równa
Po kolejnym podobnym odstępie czasu liczba ta będzie równa:

1. Radioaktywność. Podstawowe prawo rozpadu promieniotwórczego. Działalność.
2. Główne rodzaje rozpadu promieniotwórczego.
3. Ilościowa charakterystyka oddziaływania promieniowania jonizującego z materią.
4. Promieniotwórczość naturalna i sztuczna. Seria radioaktywna.
5. Zastosowanie radionuklidów w medycynie.
6. Akceleratory cząstek naładowanych i ich zastosowanie w medycynie.
7. Biofizyczne podstawy działania promieniowania jonizującego.
8. Podstawowe pojęcia i wzory.
9. Zadania.
Zainteresowanie lekarzy radioaktywnością naturalną i sztuczną wynika z następujących przyczyn.
Po pierwsze, wszystkie istoty żywe są stale narażone na naturalne promieniowanie tła, na które składa się promieniowanie kosmiczne, promieniowanie pierwiastków promieniotwórczych znajdujących się w powierzchniowych warstwach skorupy ziemskiej oraz promieniowanie pierwiastków dostających się do organizmu zwierząt wraz z powietrzem i pożywieniem.
Po drugie, promieniowanie radioaktywne wykorzystywane jest w samej medycynie do celów diagnostycznych i terapeutycznych.
33.1. Radioaktywność. Podstawowe prawo rozpadu promieniotwórczego. Działalność
Zjawisko radioaktywności odkrył w 1896 roku A. Becquerel, który zaobserwował spontaniczną emisję nieznanego promieniowania z soli uranu. Wkrótce E. Rutherford i Curie ustalili, że podczas rozpadu radioaktywnego emitowane są jądra He (cząstki α), elektrony (cząstki β) i twarde promieniowanie elektromagnetyczne (promienie γ).
W 1934 roku odkryto rozpad z emisją pozytonów (rozpad β+), a w 1940 roku odkryto nowy typ radioaktywność - spontaniczne rozszczepienie jąder: jądro rozszczepialne rozpada się na dwa fragmenty o porównywalnej masie przy jednoczesnej emisji neutronów i γ -kwanty. Protonową radioaktywność jąder zaobserwowano w 1982 roku.
Radioaktywność - zdolność niektórych jąder atomowych do spontanicznego (spontanicznego) przekształcania się w inne jądra wraz z emisją cząstek.
Jądra atomowe składają się z protonów i neutronów, które mają ogólną nazwę - nukleony. Określa liczbę protonów w jądrze właściwości chemiczne atom i jest oznaczony przez Z (to jest numer seryjnypierwiastek chemiczny). Nazywa się liczbą nukleonów w jądrze liczba masowa i oznacz A. Jądra o tej samej liczbie atomowej i różnych liczbach masowych są nazywane izotopy. Wszystkie izotopy jednego pierwiastka chemicznego mają identyczny właściwości chemiczne. Właściwości fizyczne izotopy mogą się znacznie różnić.
Do oznaczenia izotopów należy zastosować symbol pierwiastka chemicznego posiadający dwa indeksy: A Z X. Dolny indeks to numer seryjny, górny to liczba masowa. Często indeks dolny jest pomijany, ponieważ jest oznaczony przez sam symbol elementu. Na przykład piszą 14 C zamiast 14 6 C.
Zdolność jądra do rozpadu zależy od jego składu. Ten sam pierwiastek może mieć zarówno izotopy stabilne, jak i radioaktywne. Na przykład izotop węgla 12 C jest stabilny, ale izotop 14 C jest radioaktywny. Rozpad promieniotwórczy jest zjawiskiem statystycznym. Charakteryzuje się zdolnością izotopu do rozpaduλ.
stała zaniku Stały zanik
- prawdopodobieństwo, że jądro danego izotopu ulegnie rozpadowi w jednostce czasu.
Prawdopodobieństwo rozpadu jądrowego w krótkim czasie dt oblicza się ze wzoru
 Biorąc pod uwagę wzór (33.1) otrzymujemy wyrażenie określające liczbę rozpadających się jąder: Formuła (33.3) nazywana jest główną
Biorąc pod uwagę wzór (33.1) otrzymujemy wyrażenie określające liczbę rozpadających się jąder: Formuła (33.3) nazywana jest główną
prawo rozpadu promieniotwórczego.
Liczba jąder radioaktywnych maleje z czasem zgodnie z prawem wykładniczym. W praktyce zamiast tegoλ stała zaniku okres półtrwania.
często używana jest inna wielkość, tzw Pół życia połowa(T) - czas w jakim zanika
Prawo rozpadu promieniotwórczego z wykorzystaniem okresu półtrwania jest zapisane w następujący sposób:
jądra radioaktywne.
Wykres zależności (33.4) pokazano na ryc. 33.1.
 Okres półtrwania może być bardzo długi lub bardzo krótki (od ułamków sekundy do wielu miliardów lat). W tabeli Rysunek 33.1 pokazuje okresy półtrwania niektórych pierwiastków. Zmniejszenie liczby jąder substancji pierwotnej podczas rozpadu radioaktywnego
Okres półtrwania może być bardzo długi lub bardzo krótki (od ułamków sekundy do wielu miliardów lat). W tabeli Rysunek 33.1 pokazuje okresy półtrwania niektórych pierwiastków. Zmniejszenie liczby jąder substancji pierwotnej podczas rozpadu radioaktywnego
Ryż. 33.1. Tabela 33.1.
 Okresy półtrwania niektórych pierwiastków Do oceny stopień radioaktywności izotop wykorzystuje specjalną ilość zwaną
Okresy półtrwania niektórych pierwiastków Do oceny stopień radioaktywności izotop wykorzystuje specjalną ilość zwaną
działalność. Działalność -
liczba jąder leku radioaktywnego rozpadającego się w jednostce czasu: Jednostką aktywności w układzie SI jest bekerel
(Bq), 1 Bq odpowiada jednemu zdarzeniu zaniku na sekundę. W praktyce więcej dziecinna, niesystemowa jednostka działania - curie
(Ci), równa aktywności 1 g 226 Ra: 1 Ci = 3,7x10 10 Bq.
 Z biegiem czasu aktywność maleje w taki sam sposób, jak maleje liczba nierozłożonych jąder:
Z biegiem czasu aktywność maleje w taki sam sposób, jak maleje liczba nierozłożonych jąder:
33.2. Główne rodzaje rozpadu promieniotwórczego W procesie badania zjawiska radioaktywności odkryto 3 rodzaje promieni emitowanych przez jądra promieniotwórcze, które nazwano promieniami α, β i γ. Później odkryto, że cząstki α i β są iloczynami dwójki różne typy
rozpad radioaktywny, a produktem ubocznym tych procesów są promienie γ. Ponadto promienie γ towarzyszą również bardziej złożonym przemianom jądrowym, które nie są tutaj brane pod uwagę. polega na spontanicznej transformacji jąder wraz z emisjąα -cząstki (jądra helu).
Schemat rozpadu α jest zapisany jako
 gdzie X, Y są odpowiednio symbolami jądra matki i córki. Pisząc o rozpadzie α, możesz napisać „He” zamiast „α”.
gdzie X, Y są odpowiednio symbolami jądra matki i córki. Pisząc o rozpadzie α, możesz napisać „He” zamiast „α”.
Podczas tego rozpadu liczba atomowa Z pierwiastka zmniejsza się o 2, a liczba masowa A zmniejsza się o 4.
Podczas rozpadu α jądro potomne z reguły powstaje w stanie wzbudzonym i po przejściu do stanu podstawowego emituje kwant γ. Ogólną właściwością złożonych mikroobiektów jest to, że mają oddzielny zespół stanów energetycznych. Dotyczy to również jąder. Dlatego promieniowanie γ ze wzbudzonych jąder ma dyskretne widmo. W konsekwencji widmo energii cząstek α wynosi oddzielny.
Energia emitowanych cząstek α dla prawie wszystkich izotopów α-aktywnych mieści się w przedziale 4-9 MeV.
Rozpad beta polega na spontanicznej transformacji jąder z emisją elektronów (lub pozytonów).
Ustalono, że rozpadowi β towarzyszy zawsze emisja cząstki neutralnej – neutrina (lub antyneutrina). Cząstka ta praktycznie nie oddziałuje z materią i nie będzie dalej rozpatrywana. Energia uwalniana podczas rozpadu beta jest rozdzielana losowo pomiędzy cząstkę beta i neutrino. Dlatego widmo energii promieniowania β jest ciągłe (ryc. 33.2).
 Ryż. 33.2. Widmo energetyczne rozpadu β
Ryż. 33.2. Widmo energetyczne rozpadu β
Istnieją dwa rodzaje rozpadu β.
1. Elektroniczny Rozpad β - - polega na przekształceniu jednego neutronu jądrowego w proton i elektron.
 W tym przypadku pojawia się kolejna cząstka ν” – antyneutrino:
W tym przypadku pojawia się kolejna cząstka ν” – antyneutrino:
 Z jądra wylatują elektron i antyneutrino. Schemat rozpadu elektronu β zapisano w postaci
Z jądra wylatują elektron i antyneutrino. Schemat rozpadu elektronu β zapisano w postaci
Podczas elektronicznego rozpadu β liczba porządkowa pierwiastka Z wzrasta o 1, ale liczba masowa A nie ulega zmianie.
Energia cząstek β mieści się w przedziale 0,002-2,3 MeV. 2. Pozytonowy
 Rozpad β+ polega na przekształceniu jednego protonu jądrowego w neutron i pozyton. W tym przypadku pojawia się kolejna cząstka ν – neutrino: Samo wychwytywanie elektronów nie powoduje wytwarzania cząstek jonizujących, ale tak się dzieje
Rozpad β+ polega na przekształceniu jednego protonu jądrowego w neutron i pozyton. W tym przypadku pojawia się kolejna cząstka ν – neutrino: Samo wychwytywanie elektronów nie powoduje wytwarzania cząstek jonizujących, ale tak się dzieje
towarzyszy promieniowanie rentgenowskie. Promieniowanie to występuje, gdy przestrzeń zwolniona w wyniku absorpcji elektronu wewnętrznego zostaje wypełniona elektronem z orbity zewnętrznej.λ ≤ Promieniowanie gamma
Promieniowanie gamma nie jest niezależnym rodzajem rozpadu promieniotwórczego. Promieniowanie tego typu prawie zawsze towarzyszy nie tylko rozpadowi α i β, ale także bardziej złożonym reakcjom jądrowym. Nie ulega odchyleniu od pól elektrycznych i magnetycznych, ma stosunkowo słabą zdolność jonizującą i bardzo wysoką zdolność penetracji.
33.3. Ilościowa charakterystyka oddziaływania promieniowania jonizującego z materią
Wpływ promieniowania radioaktywnego na organizmy żywe wiąże się z jonizacja, które powoduje w tkankach. Zdolność cząstki do jonizacji zależy zarówno od jej rodzaju, jak i energii. Gdy cząstka wnika głębiej w materię, traci swoją energię. Proces ten nazywa się hamowanie jonizacji.
Aby ilościowo scharakteryzować oddziaływanie naładowanej cząstki z materią, stosuje się kilka wielkości:
 Gdy energia cząstki spadnie poniżej energii jonizacji, jej działanie jonizujące ustanie.
Gdy energia cząstki spadnie poniżej energii jonizacji, jej działanie jonizujące ustanie.
Średni przebieg liniowy(R) naładowanej cząstki jonizującej - droga, jaką przebywa ona w substancji, zanim utraci zdolność jonizującą.
Spójrzmy na niektóre cechy charakterystyczne oddziaływania różnych rodzajów promieniowania z materią.
Promieniowanie alfa
Cząstka alfa praktycznie nie odbiega od początkowego kierunku swojego ruchu, gdyż jej masa jest wielokrotnie większa
 Ryż. 33.3. Zależność gęstości liniowej jonizacji od drogi, jaką przebywa cząstka α w ośrodku
Ryż. 33.3. Zależność gęstości liniowej jonizacji od drogi, jaką przebywa cząstka α w ośrodku
masa elektronu, z którym oddziałuje. Gdy wnika głęboko w substancję, gęstość jonizacji najpierw wzrasta i kiedy zakończenie przebiegu (x = R) spada gwałtownie do zera (ryc. 33.3). Wyjaśnia to fakt, że wraz ze spadkiem prędkości ruchu wzrasta czas przebywania w pobliżu cząsteczki (atomu) ośrodka. W tym przypadku wzrasta prawdopodobieństwo jonizacji. Gdy energia cząstki α stanie się porównywalna z energią molekularnego ruchu termicznego, wychwytuje ona dwa elektrony w substancji i zamienia się w atom helu.
Elektrony powstałe w procesie jonizacji z reguły oddalają się od toru cząstek α i powodują jonizację wtórną.
Charakterystykę oddziaływania cząstek α z wodą i tkankami miękkimi przedstawiono w tabeli. 33.2.
Tabela 33.2. Zależność charakterystyki oddziaływania z materią od energii cząstek α
 Promieniowanie beta
Promieniowanie beta
Do ruchu β -cząstki w materii charakteryzują się krzywoliniową, nieprzewidywalną trajektorią. Wynika to z równości mas oddziałujących cząstek.
Charakterystyka interakcji β -cząstki z wodą i tkankami miękkimi przedstawiono w tabeli. 33.3.
Tabela 33.3. Zależność charakterystyki oddziaływania z materią od energii cząstek β
 Podobnie jak cząstki α, zdolność jonizacji cząstek β wzrasta wraz ze spadkiem energii.
Podobnie jak cząstki α, zdolność jonizacji cząstek β wzrasta wraz ze spadkiem energii.
towarzyszy promieniowanie rentgenowskie.
Wchłanianie γ -promieniowanie przez materię podlega prawu wykładniczemu podobnemu do prawa absorpcji promieniowania rentgenowskiego:
Główne procesy odpowiedzialne za wchłanianie γ -promieniowanie to efekt fotoelektryczny i rozpraszanie Comptona. W wyniku tego powstaje stosunkowo niewielka liczba wolnych elektronów (jonizacja pierwotna), które mają bardzo wysoką energię. Powodują procesy jonizacji wtórnej, która jest nieporównywalnie większa od pierwotnej.
33,4. Naturalne i sztuczne
radioaktywność. Seria radioaktywna
Warunki naturalny I sztuczny radioaktywność jest warunkowa.
Naturalny nazywana radioaktywnością izotopów występujących w przyrodzie lub radioaktywnością izotopów powstałych w wyniku procesów naturalnych.
Na przykład radioaktywność uranu jest naturalna. Naturalna jest także radioaktywność węgla 14 C, który powstaje w górnych warstwach atmosfery pod wpływem promieniowania słonecznego.
Sztuczny nazywana radioaktywnością izotopów powstających w wyniku działalności człowieka.
Jest to radioaktywność wszystkich izotopów wytwarzanych w akceleratorach cząstek. Obejmuje to również radioaktywność gleby, wody i powietrza, która występuje podczas wybuchu atomowego.
Naturalna radioaktywność
W początkowym okresie badań radioaktywności badacze mogli wykorzystywać jedynie naturalne radionuklidy (izotopy promieniotwórcze) zawarte w skałach ziemskich w odpowiednio dużych ilościach: 232 Th, 235 U, 238 U. Od tych radionuklidów rozpoczynają się trzy serie radioaktywne, a kończą się izotopami stabilnymi Pb. Następnie odkryto serię zaczynającą się od 237 Np, a końcowym stabilnym jądrem 209 Bi. Na ryc. Rysunek 33.4 przedstawia rząd rozpoczynający się od 238 U.
 Ryż. 33,4. Seria uranowo-radowa
Ryż. 33,4. Seria uranowo-radowa
Elementy tej serii są głównym źródłem wewnętrznego promieniowania człowieka. Na przykład 210 Pb i 210 Po dostają się do organizmu z pożywieniem - gromadzą się w rybach i skorupiakach. Obydwa te izotopy kumulują się w porostach i dlatego są obecne w mięsie renifer. Najważniejszym ze wszystkich naturalnych źródeł promieniowania jest 222 Rn – ciężki gaz obojętny powstający w wyniku rozpadu 226 Ra. Stanowi około połowy dawki naturalnego promieniowania otrzymywanego przez człowieka. Formowanie się, gaz ten przedostaje się do atmosfery i przedostaje się do wody (jest wysoce rozpuszczalny).
W skorupie ziemskiej stale występuje radioaktywny izotop potasu 40 K, który wchodzi w skład naturalnego potasu (0,0119%). Z gleby pierwiastek ten przedostaje się przez system korzeniowy roślin oraz wraz z pokarmami roślinnymi (zboża, świeże warzywa i owoce, grzyby) do organizmu.
Kolejnym źródłem promieniowania naturalnego jest promieniowanie kosmiczne (15%). Jego intensywność wzrasta na obszarach górskich ze względu na zmniejszenie ochronnego działania atmosfery. Źródła naturalnego promieniowania tła zestawiono w tabeli. 33,4.
Tabela 33.4. Składnik naturalnego tła promieniotwórczego
 33,5. Zastosowanie radionuklidów w medycynie
33,5. Zastosowanie radionuklidów w medycynie
Radionuklidy nazywane są radioaktywnymi izotopami pierwiastków chemicznych o krótkim okresie półtrwania. Takie izotopy nie występują w przyrodzie, dlatego są uzyskiwane sztucznie. We współczesnej medycynie radionuklidy są szeroko stosowane w celach diagnostycznych i terapeutycznych.
Aplikacja diagnostyczna opiera się na selektywnej akumulacji określonych pierwiastków chemicznych przez poszczególne narządy. Na przykład jod koncentruje się w tarczycy, a wapń w kościach.
Wprowadzenie do organizmu radioizotopów tych pierwiastków umożliwia wykrycie obszarów ich koncentracji za pomocą promieniowania radioaktywnego i uzyskanie w ten sposób ważnych informacji diagnostycznych. Ta metoda diagnostyczna nazywa się metodą znakowanego atomu.
Zastosowanie terapeutyczne radionuklidów opiera się na destrukcyjnym działaniu promieniowania jonizującego na komórki nowotworowe.
1. Terapia gamma- zastosowanie wysokoenergetycznego promieniowania γ (źródło 60 Co) do niszczenia głęboko położonych guzów. Aby zapobiec szkodliwemu działaniu powierzchniowych tkanek i narządów, narażenie na promieniowanie jonizujące przeprowadza się w różnych sesjach w różnych kierunkach.
2. Terapia alfa- terapeutyczne zastosowanie cząstek α. Cząsteczki te charakteryzują się znaczną liniową gęstością jonizacji i są pochłaniane przez nawet niewielką warstwę powietrza. Dlatego terapeutyczny
Zastosowanie promieni alfa możliwe jest poprzez bezpośredni kontakt z powierzchnią narządu lub podanie wewnętrzne (za pomocą igły). W przypadku narażenia powierzchniowego stosuje się terapię radonem (222 Rn): narażenie przez skórę (kąpiele), narządy trawienne (picie) i narządy oddechowe (inhalacja).
W niektórych przypadkach zastosowanie lecznicze α -cząstki są związane z wykorzystaniem strumienia neutronów. Metodą tą w pierwszej kolejności do tkanki (guza) wprowadzane są pierwiastki, których jądra pod wpływem neutronów emitują α -cząstki. Następnie chory narząd naświetla się strumieniem neutronów. W ten sposób α -cząstki powstają bezpośrednio wewnątrz narządu, na który powinny działać destrukcyjnie.
Tabela 33.5 przedstawia charakterystykę niektórych radionuklidów stosowanych w medycynie.
Tabela 33.5. Charakterystyka izotopów
 33,6. Akceleratory cząstek naładowanych i ich zastosowanie w medycynie
33,6. Akceleratory cząstek naładowanych i ich zastosowanie w medycynie
Akcelerator- instalacja, w której pod wpływem pól elektrycznych i magnetycznych powstają ukierunkowane wiązki naładowanych cząstek o dużej energii (od setek keV do setek GeV).
Akceleratory tworzą wąski wiązki cząstek o danej energii i małym przekroju. Dzięki temu możesz zapewnić skierowany wpływ na napromieniowane obiekty.
Zastosowanie akceleratorów w medycynie
Akceleratory elektronów i protonów znajdują zastosowanie w medycynie w radioterapii i diagnostyce. Wykorzystuje się w tym przypadku zarówno same przyspieszane cząstki, jak i towarzyszące im promieniowanie rentgenowskie.
Rentgen Bremsstrahlunga uzyskuje się poprzez skierowanie wiązki cząstek na specjalny cel, będący źródłem promieni rentgenowskich. Promieniowanie to różni się od lampy rentgenowskiej znacznie wyższą energią kwantową.
Synchrotronowe promieniowanie rentgenowskie zachodzi podczas przyspieszania elektronów w akceleratorach pierścieniowych – synchrotronach. Takie promieniowanie ma wysoki stopień kierunkowości.
Bezpośrednie działanie szybkich cząstek wiąże się z ich dużą zdolnością penetracji. Cząsteczki takie przechodzą przez tkanki powierzchniowe, nie powodując poważnych uszkodzeń, a na końcu swojej podróży działają jonizująco. Dobierając odpowiednią energię cząstek, możliwe jest zniszczenie nowotworów na danej głębokości.
Obszary zastosowania akceleratorów w medycynie przedstawiono w tabeli. 33,6.
Tabela 33.6. Zastosowanie akceleratorów w terapii i diagnostyce
 33,7. Biofizyczne podstawy działania promieniowania jonizującego
33,7. Biofizyczne podstawy działania promieniowania jonizującego
Jak wspomniano powyżej, wpływ promieniowania radioaktywnego na układy biologiczne jest związany z jonizacja cząsteczek. Proces oddziaływania promieniowania z komórkami można podzielić na trzy kolejne etapy (etapy).
1. Etap fizyczny składa się z transfer energii promieniowanie do cząsteczek układ biologiczny, co powoduje ich jonizację i wzbudzenie. Czas trwania tego etapu wynosi 10 -16 -10 -13 s.
2. Fizykochemiczne etap ten składa się z różnego rodzaju reakcji prowadzących do redystrybucji nadmiaru energii wzbudzonych cząsteczek i jonów. W rezultacie bardzo aktywny
produkty: rodniki i nowe jony o szerokim zakresie właściwości chemicznych.
Czas trwania tego etapu wynosi 10 -13 -10 -10 s.
3. Etap chemiczny - jest to oddziaływanie rodników i jonów między sobą oraz z otaczającymi cząsteczkami. Na tym etapie powstają różnego rodzaju uszkodzenia strukturalne, prowadzące do zmian we właściwościach biologicznych: zaburzona zostaje struktura i funkcje błon; zmiany zachodzą w cząsteczkach DNA i RNA.
Czas trwania etapu chemicznego wynosi 10 -6 -10 -3 s.
4. Etap biologiczny. Na tym etapie uszkodzenie cząsteczek i struktur subkomórkowych prowadzi do różnych zaburzeń funkcjonalnych, do przedwczesnej śmierci komórki w wyniku działania mechanizmów apoptotycznych lub na skutek martwicy. Uszkodzenia otrzymane na etapie biologicznym można odziedziczyć.
Czas trwania etapu biologicznego waha się od kilku minut do kilkudziesięciu lat.
Zwróćmy uwagę na ogólne wzorce etapu biologicznego:
Duże zaburzenia o niskiej pochłoniętej energii (śmiertelna dawka promieniowania dla człowieka powoduje nagrzanie organizmu zaledwie o 0,001°C);
Wpływ na kolejne pokolenia poprzez dziedziczny aparat komórkowy;
Charakteryzuje się ukrytym, utajonym okresem;
Różne części komórek mają różną wrażliwość na promieniowanie;
Przede wszystkim wpływa to na dzielące się komórki, co jest szczególnie niebezpieczne dla organizmu dziecka;
Szkodliwy wpływ na tkanki dorosłego organizmu, w którym następuje podział;
Podobieństwo zmian radiacyjnych z patologią wczesnego starzenia się.
33,8. Podstawowe pojęcia i wzory
 Kontynuacja tabeli
Kontynuacja tabeli
 33,9. Zadania
33,9. Zadania
1. Jaka jest aktywność leku, jeśli w ciągu 10 minut rozpadnie się 10 000 jąder tej substancji?
 4.
Wiek starożytnych próbek drewna można w przybliżeniu określić na podstawie specyficznej aktywności masowej zawartego w nich izotopu 14 6 C. Ile lat temu ścięto drzewo, z którego wykonano przedmiot, jeśli specyficzna aktywność masowa zawartego w nim węgla wynosi 75% właściwej aktywności masowej rosnącego drzewa? Okres półtrwania radonu wynosi T = 5570 lat.
4.
Wiek starożytnych próbek drewna można w przybliżeniu określić na podstawie specyficznej aktywności masowej zawartego w nich izotopu 14 6 C. Ile lat temu ścięto drzewo, z którego wykonano przedmiot, jeśli specyficzna aktywność masowa zawartego w nim węgla wynosi 75% właściwej aktywności masowej rosnącego drzewa? Okres półtrwania radonu wynosi T = 5570 lat.
 9.
Po awarii w Czarnobylu w niektórych miejscach zanieczyszczenie gleby radioaktywnym cezem-137 osiągnęło poziom 45 Ci/km 2 .
9.
Po awarii w Czarnobylu w niektórych miejscach zanieczyszczenie gleby radioaktywnym cezem-137 osiągnęło poziom 45 Ci/km 2 .
Po ilu latach aktywność w tych miejscach spadnie do w miarę bezpiecznego poziomu 5 Ci/km 2? Okres półtrwania cezu-137 wynosi T = 30 lat.
 10.
Dopuszczalna aktywność jodu-131 w tarczycy człowieka nie powinna przekraczać 5 nCi. U niektórych osób znajdujących się w strefie katastrofy w Czarnobylu aktywność jodu-131 osiągnęła 800 nCi. Po ilu dniach aktywność spadła do normy? Okres półtrwania jodu-131 wynosi 8 dni.
10.
Dopuszczalna aktywność jodu-131 w tarczycy człowieka nie powinna przekraczać 5 nCi. U niektórych osób znajdujących się w strefie katastrofy w Czarnobylu aktywność jodu-131 osiągnęła 800 nCi. Po ilu dniach aktywność spadła do normy? Okres półtrwania jodu-131 wynosi 8 dni.
 11.
Aby określić objętość krwi zwierzęcia, stosuje się następującą metodę. Od zwierzęcia pobiera się niewielką objętość krwi, czerwone krwinki oddziela się od osocza i umieszcza w roztworze z radioaktywnym fosforem, który jest przyswajany przez czerwone krwinki. Wyznakowane czerwone krwinki ponownie wprowadza się do układu krążenia zwierzęcia i po pewnym czasie określa się aktywność próbki krwi.
11.
Aby określić objętość krwi zwierzęcia, stosuje się następującą metodę. Od zwierzęcia pobiera się niewielką objętość krwi, czerwone krwinki oddziela się od osocza i umieszcza w roztworze z radioaktywnym fosforem, który jest przyswajany przez czerwone krwinki. Wyznakowane czerwone krwinki ponownie wprowadza się do układu krążenia zwierzęcia i po pewnym czasie określa się aktywność próbki krwi.
ΔV = 1 ml takiego roztworu wstrzyknięto do krwi jakiegoś zwierzęcia. Początkowa aktywność tej objętości była równa A 0 = 7000 Bq. Aktywność 1 ml krwi pobranej dzień później z żyły zwierzęcia wynosiła 38 uderzeń na minutę. Określ objętość krwi zwierzęcia, jeśli okres półtrwania radioaktywnego fosforu wynosi T = 14,3 dnia.
§ 15-g. Prawo rozpadu promieniotwórczego
Pojawienie się „ręcznych” liczników scyntylacyjnych, a przede wszystkim liczników Geigera-Mullera, które pomogły zautomatyzować zliczanie cząstek (patrz § 15), doprowadziło fizyków do ważnego wniosku. Każdy izotop promieniotwórczy charakteryzuje się samoistnym osłabieniem radioaktywności, wyrażającym się zmniejszeniem liczby rozpadających się jąder w jednostce czasu.
Sporządzenie wykresów aktywności różnych izotopów promieniotwórczych doprowadziło naukowców do tej samej wyrażonej zależności funkcja wykładnicza (patrz wykres). Oś pozioma pokazuje czas obserwacji, a oś pionowa pokazuje liczbę nierozłożonych jąder. Krzywizna linii mogła być inna, ale sama funkcja, która wyrażała zależności opisane na wykresach, pozostała ta sama:
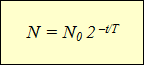
Ta formuła wyraża prawo rozpadu promieniotwórczego: liczbę jąder, które nie uległy rozpadowi w czasie, określa się jako iloczyn początkowej liczby jąder przez 2 do potęgi równej stosunkowi czasu obserwacji do okresu półtrwania, przyjmowanego ze znakiem ujemnym.
Jak się okazało podczas eksperymentów, różne substancje radioaktywne mogą charakteryzować się różnymi cechami okres półtrwania– czas, w którym liczba jeszcze nierozłożonych jąder zmniejsza się o połowę(patrz tabela).
Okresy półtrwania niektórych izotopów niektórych pierwiastków chemicznych. Wartości podano zarówno dla izotopów naturalnych, jak i sztucznych.
| Jod-129 | 15 milionów | Węgiel-14 | 5,7 tys. lat | |
| Jod-131 | 8 dni | Uran-235 | 0,7 miliarda lat | |
| Jod-135 | 7 godzina | Uran-238 | 4,5 miliarda lat |
Okres półtrwania – ogólnie przyjęty wielkość fizyczna, charakteryzujący szybkość rozpadu promieniotwórczego. Pokazują to liczne eksperymenty nawet przy bardzo długiej obserwacji substancji radioaktywnej jej okres półtrwania jest stały, to znaczy nie zależy od liczby atomów, które już uległy rozkładowi. Dlatego prawo rozpadu promieniotwórczego znalazło zastosowanie w sposobie określania wieku znalezisk archeologicznych i geologicznych.
Metoda datowania radiowęglowego. Węgiel jest bardzo powszechnym pierwiastkiem chemicznym na Ziemi, obejmującym stabilne izotopy węgiel-12, węgiel-13 i radioaktywny izotop węgiel-14, którego okres półtrwania wynosi 5,7 tys. lat (patrz tabela). Organizmy żywe, spożywając pożywienie, gromadzą w swoich tkankach wszystkie trzy izotopy. Po zakończeniu życia organizmu dopływ węgla ustaje, a z biegiem czasu jego zawartość w sposób naturalny zmniejsza się na skutek rozpadu radioaktywnego. Ponieważ rozpada się tylko węgiel-14, stosunek izotopów węgla w pozostałościach kopalnych organizmów żywych zmienia się na przestrzeni wieków i tysiącleci. Mierząc tę „proporcję węgla”, możemy ocenić wiek znaleziska archeologicznego.
Metodę analizy radiowęglowej można stosować w przypadku skał geologicznych, a także kopalnych obiektów ludzkich, pod warunkiem jednak, że w czasie jej istnienia stosunek izotopów w próbce nie został zakłócony np. przez pożar lub działanie silnego źródła promieniowania. Nieuwzględnienie takich powodów bezpośrednio po odkryciu tej metody doprowadziło do błędów przez kilka stuleci i tysiącleci. Obecnie dla izotopu węgla-14 stosuje się „świeckie skale kalibracyjne” na podstawie jego rozmieszczenia w drzewach długowiecznych (na przykład amerykańskiej sekwoi tysiącletniej). Ich wiek można bardzo dokładnie obliczyć - na podstawie rocznych słojów drewna.
Granice zastosowania metody datowania radiowęglowego w początek XXI wiek wynosił 60 000 lat. Do pomiaru wieku starszych próbek, takich jak skały czy meteoryty, stosuje się podobną metodę, ale zamiast węgla patrzy się na izotopy uranu lub innych pierwiastków, w zależności od pochodzenia badanej próbki.
JavaScript jest wyłączony w Twojej przeglądarce.Aby wykonać obliczenia, musisz włączyć kontrolki ActiveX!
PRACA LABORATORYJNA nr 19
BADANIE PRAWA ROZPADU PROMIENIOTWÓRCZEGO
I SPOSOBY OCHRONY PRZED PROMIENIOWANIEM RADIOAKTYWNYM
Cel pracy : 1) badanie prawa rozpadu promieniotwórczego; 2) badanie prawa absorpcji promieni g i b przez materię.
Cele pracy : 1) wyznaczanie współczynników liniowej absorpcji promieniowania radioaktywnego różnych materiałów; 2) określenie grubości warstwy półtłumiącej tych materiałów; 3) wyznaczanie okresu półtrwania i stałej rozpadu pierwiastka chemicznego.
Środki wspierające : Komputer z systemem Windows.
CZĘŚĆ TEORETYCZNA
Wstęp
Skład jądra atomowego
Jądro dowolnego atomu składa się z dwóch rodzajów cząstek - protonów i neutronów. Proton to jądro najprostszego atomu – wodoru. Ma ładunek dodatni, równy ładunkowi elektronu i masę 1,67 × 10-27 kg. Neutron, którego istnienie stwierdził dopiero w 1932 roku Anglik James Chadwick, jest elektrycznie obojętny, a jego masa jest prawie taka sama jak protonu. Neutrony i protony, które są dwoma elementami składowymi jądra atomowego, nazywane są wspólnie nukleonami. Liczba protonów w jądrze (lub nuklidzie) nazywana jest liczbą atomową i jest oznaczona literą Z. Całkowita liczba nukleonów, tj. neutrony i protony, oznaczone literą A i zwane liczbą masową. Pierwiastki chemiczne są zwykle oznaczane symbolem lub, gdzie X jest symbolem pierwiastka chemicznego.
Radioaktywność
Zjawisko radioaktywności polega na samoistnym (spontanicznym) przekształceniu jąder niektórych pierwiastków chemicznych w jądra innych pierwiastków z emisją promieniowania radioaktywnego.
Jądra ulegające takiemu rozpadowi nazywane są radioaktywnymi. Jądra, które nie ulegają rozpadowi radioaktywnemu, nazywane są stabilnymi. W procesie rozpadu zmienia się zarówno liczba atomowa Z, jak i liczba masowa A jądra.
Przekształcenia radioaktywne zachodzą samoistnie. Na prędkość ich przepływu nie mają wpływu zmiany temperatury i ciśnienia, obecność pól elektrycznych i magnetycznych, rodzaj związku chemicznego danego pierwiastka promieniotwórczego oraz stan jego skupienia.
Rozpad promieniotwórczy charakteryzuje się czasem jego wystąpienia, rodzajem i energiami emitowanych cząstek, a w przypadku ucieczki kilku cząstek z jądra, także względnymi kątami pomiędzy kierunkami emisji cząstek. Historycznie rzecz biorąc, radioaktywność jest pierwszym procesem jądrowym odkrytym przez człowieka (A. Becquerel, 1896).
Rozróżnia się radioaktywność naturalną i sztuczną.
Naturalna radioaktywność występuje w niestabilnych jądrach, które istnieją warunki naturalne. Sztuczna jest radioaktywność jąder powstałych w wyniku różnych reakcji jądrowych. Nie ma zasadniczej różnicy pomiędzy radioaktywnością sztuczną i naturalną. Mają wspólne wzorce.
W jądra atomowe Możliwe i rzeczywiście obserwowane są cztery główne typy radioaktywności: a-rozpad, b-rozpad, g-rozpad i spontaniczne rozszczepienie.
Zjawisko rozpadu a polega na tym, że ciężkie jądra spontanicznie emitują cząstki a (jądra helu 2 H 4). W tym przypadku liczba masowa jądra zmniejsza się o cztery jednostki, a liczba atomowa o dwie:
Z X A® Z -2 Y A-4 + 2 H 4 .
Cząstka a składa się z czterech nukleonów: dwóch neutronów i dwóch protonów.
W procesie rozpadu promieniotwórczego jądro może emitować nie tylko cząstki wchodzące w jego skład, ale także nowe cząstki, które powstają w procesie rozpadu. Procesy tego rodzaju to rozpady b i g.
Koncepcja rozpadu b łączy w sobie trzy rodzaje przemian jądrowych: rozpad elektronu (b -), rozpad pozytonu (b +) i wychwyt elektronów.
Zjawisko rozpadu b polega na tym, że jądro samoistnie emituje elektron e - oraz najlżejszą elektrycznie obojętną cząstkę antyneutrino, przechodząc do jądra o tej samej liczbie masowej A, ale o liczbie atomowej Z, ale większej niż jeden:
Z X A ® Z +1 Y A + e - + .
Należy podkreślić, że elektron emitowany podczas rozpadu b nie jest powiązany z elektronami orbitalnymi. Rodzi się w samym jądrze: jeden z neutronów zamienia się w proton i jednocześnie emituje elektron.
Innym rodzajem rozpadu b jest proces, w którym jądro emituje pozyton e + i inną najlżejszą elektrycznie obojętną cząstkę, neutrino n. W tym przypadku jeden z protonów zamienia się w neutron:
Z X A ® Z -1 Y A + e + +n.
Rozpad ten nazywany jest rozpadem pozytonowym lub b+.
Do zakresu zjawisk rozpadu b zalicza się także wychwyt elektronów (często nazywany również wychwytem K), podczas którego jądro absorbuje jeden z elektronów powłoki atomowej (zwykle z powłoki K), emitując neutrino. W tym przypadku, podobnie jak w przypadku rozpadu pozytonu, jeden z protonów zamienia się w neutron:
e - + Z X A ® Z -1 Y A +n.
Promieniowanie G obejmuje fale elektromagnetyczne, których długość jest znacznie mniejsza niż odległości międzyatomowe:
gdzie d - jest rzędu 10 -8 cm. Na obrazie korpuskularnym promieniowanie to jest strumieniem cząstek zwanym kwantami g. Dolna granica energii kwantów g
mi= 2p s/l
jest rzędu kilkudziesięciu keV. Nie ma naturalnego górnego limitu. Nowoczesne akceleratory wytwarzają kwanty o energiach do 20 GeV.
Rozpad jądra z emisją promieniowania g pod wieloma względami przypomina emisję fotonów przez wzbudzone atomy. Podobnie jak atom, jądro może znajdować się w stanie wzbudzonym. Po przejściu do stanu o niższej energii, czyli stanu podstawowego, jądro emituje foton. Ponieważ promieniowanie g nie niesie ładunku, podczas rozpadu g nie następuje przemiana jednego pierwiastka chemicznego w drugi.
Podstawowe prawo rozpadu promieniotwórczego
Rozpad radioaktywny jest zjawiskiem statystycznym: nie da się przewidzieć, kiedy dane niestabilne jądro ulegnie rozpadowi, można jedynie dokonać pewnych probabilistycznych ocen tego zdarzenia. Dla dużego zbioru jąder radioaktywnych można otrzymać prawo statystyczne wyrażające zależność jąder nierozłożonych od czasu.
Niech jądra rozpadną się w wystarczająco krótkim odstępie czasu. Liczba ta jest proporcjonalna do przedziału czasu, a także całkowitej liczby jąder radioaktywnych:
![]() , (1)
, (1)
gdzie jest stałą rozpadu, proporcjonalną do prawdopodobieństwa rozpadu jądra promieniotwórczego i różną dla różnych substancji promieniotwórczych. Znak „-” umieszczony jest dlatego, że< 0, так как число не распавшихся радиоактивных ядер убывает со временем.
Rozdzielmy zmienne i całkujmy (1) biorąc pod uwagę, że dolne granice całkowania odpowiadają warunkom początkowym (w , gdzie jest początkowa liczba jąder promieniotwórczych), a górne granice odpowiadają wartościom bieżącym oraz :
 (2)
(2)
Wyrażenie wzmacniające (3) mamy
To jest to podstawowe prawo rozpadu promieniotwórczego: liczba nierozłożonych jąder promieniotwórczych maleje z czasem zgodnie z prawem wykładniczym.

Rysunek 1 przedstawia krzywe rozpadu 1 i 2, odpowiadające substancjom o różnych stałych rozpadu (λ 1 > λ 2), ale o tej samej początkowej liczbie jąder promieniotwórczych. Linia 1 odpowiada bardziej aktywnemu elementowi.
W praktyce zamiast stałej rozpadu częściej stosuje się inną cechę izotopu promieniotwórczego - okres półtrwania . Jest to czas, w którym rozpada się połowa jąder promieniotwórczych. Oczywiście ta definicja jest wystarczająca duża liczba rdzenie. Rysunek 1 pokazuje, jak za pomocą krzywych 1 i 2 można znaleźć okresy półtrwania jąder: narysuj linię prostą równoległą do osi odciętych przez punkt rzędnych, aż przetnie się ona z krzywymi. Odcięte punktów przecięcia linii prostej i linii 1 i 2 podają okresy półtrwania T 1 i T 2.





